مقدمه:
هضم چربی ها در بدن ماهی همانند کربوهیدراتها و پروتئین نیست. چربی ها در آب نامحلول هستند و برای ورود به مایع گوارشی و فعال شدن آنزیم های آن نیاز به یک فرایند جهت محلول شدن چربی است. اولین مرحله در هضم چربی را امولسیفه شدن چربی می باشد که در آن آنزیم ها نمی توانند روی توده ای از چربی فعالیت کنندو به دلیل اینکه آنزیم های هضم نیز محلول در آب می باشند بایستی مولکول های چربی به شکل تری گلیسرید های محلول در آب در آمده تا آنزیم های بتوانند روی آنها عمل کنند. این فرایند را امولیسیفه کردن چربی می گویند. آرتیفایر امولسیفایر قوی پنج جزئی ای است که می تواند در فرآیند امولسیفیه کردن چربی به طور موثری عمل نماید.
به صورت طبیعی در آبزیان امولسیفه شدن چربی ها از طریق اثر اسیدهای صفراوی و فسفولیپیدهای لستین بدست می آیند و هر دو این مولکول ها از کبد ترشح می شوند. این مولکول ها هم در آب و هم در چربی قابل حل هستند. وقتی چربی وارد محیط آبی روده می شود توسط اسیدهای صفراوی و فسفولیپیدها تشکیل میسل می دهند. در روده فسفولیپیدها ابتدا تحت تاثیر آنزیم ها به لیزوفسفولیپید ها تبدیل می شوند سپس در ساختار میسل شرکت کرده و موجب ثبات میسل ها می گردند.
مرحله بعدی هضم چربی ها اثر آنزیم های مختلف هضم کننده چربی روی این چربی های امولسیفه شده است که موجب شکسته شدن آنها می شود. لیپاز پانکراس بیشترین اهمیت را برای هضم چربی ها دارد و بیشترین میزان از آن تولید می شود. لیپازهای پانکراس تری گلیسیرید ها را به اسیدهای چرب و مونوگلیسیرید ها هیدرولیز می کنند.
مرحله انتهایی هضم چربی ها تشکیل نانومیسل ها و جذب آنها از طریق روده است. سطح میسل ها دارای قسمتی قطبی و آب دوست است این بخش از میسل موجب می شود که چربی در شیره گوارشی پخش شده و به سرعت توسط روده جذب شود و همجنین میسل ها به انتقال چربی ها در سلول های روده و جذب آنها نیز کمک می کنند.
نوع چربی مورد استفاده در جیره آبزیان از نظر منبع گیاهی یا حیوانی، ساختار چربی، نقطه ذوب، طول زنجیره اسیدهای چرب، اشباع یا غیر اشباع بودن میتواند در مقدار هضم و جذب و انتقال چربی ها موثر باشد. برخی عوامل نیز میتوانند بطور غیر مستقیم و از طریق جیره بر هضم چربی جیره موثر باشند. علاوه بر عوامل تغذیهای ، شرایط محیطی (دما) نیز بر متابولیسم چربی در آبزیان تاثیر ویژه ای دارد.
استفاده از چربی ها در جیره آبزیان یک استراتژی جهت تامین احتیاجات انرژی، کاهش تلفات، افزایش چربی بدن، کاهش هزینه های تولید، ارتقاء جذب ویتامین های محلول در چربی و بهبود ضریب تبدیل میباشد. با توجه به اهمیت ذکر شده ماهیت چربی جیره و هضم، جذب و انتقال آن (متابولیسم چربی) تحت تاثیر عواملی متعددی قرار میگیرد. شناخت ماهیت چربی مورد استفاده در جیره و عوامل موثر بر متابولیسم چربیها میتواند موجب بهره گیری از حداکثر پتانسیل چربیها در جهت نیل به استراتژی تغذیه ای چربیها باشد.
اهمیت فسفولیپیدها (فسفولیپید یا لیزو فسفولیپید) در جیره آبزیان
- 1-فسفولیپیدها از گروه اصلی چربیهای غشاء سلولی و تمامی غشاء های زیستی هستند و علاوه بر نقش ساختاری نقش حیاتی را در هضم ، جذب و انتقال مواد غذایی در دستگاه گوارش بر عهده دارند (Tocher et al. 2008).
- 2-امروزه استفاده از لیزو فسفولیپیدها و فسفولیپیدها یک استراتژی موثر برای فراهم سازی شرایط ایده آل برای کاهش سطح پروتئین حیوانی جیره آبزیان است و با اهدافی همچون کاهش وابستگی به پروتئین های حیوانی و کاهش هزینه جیره بکار میرود (Heidi et al. 2015)
- 3-آبزیان نابالغ اغلب توانایی سنتز مقدار کافی فسفولیپید ها را برای تامین احتیاجات خود ندارند، بنابراین تامین آن از طریق جیره برای رشد، کاهش تلفات، ضریب تبدیل و سلامت ضروری است. (Coutteau et al. 1997)
- 4-کولین و اینوزیتول که نقش بسیار مهمی در متابولیسم و جذب چربی ها دارند در حالت آزاد جذب بسیار کمتری در مقایسه با زمانی که همراه و متصل به فسفو یا ایزوفسفولیپیدها هستند، دارند. (Coutteau et al. 1997) یادمان نرود که این مواد به عنوان امولسیفایر در صنایع غذایی و دارویی کاربرد فراوان دارند ((Kasinos et al.2014

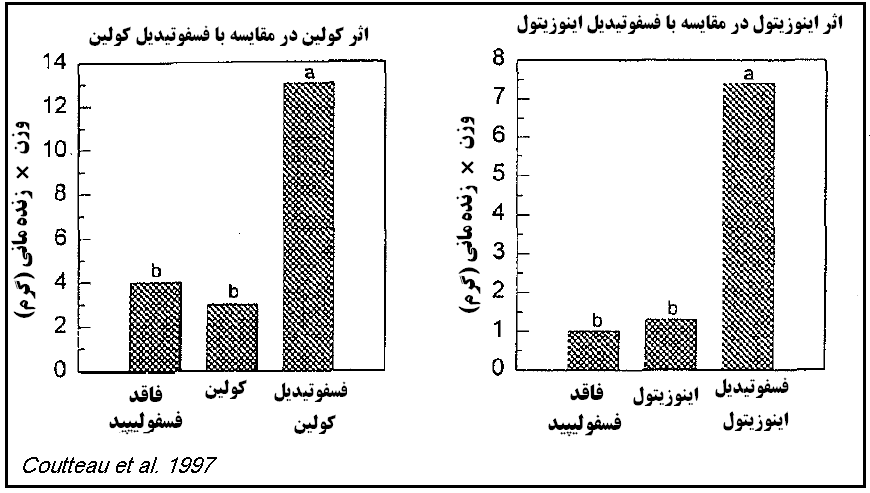
دستگاه گوارش گونه های مختلف آبزیان بسیار متفاوت است با این حال در اغلب گونه های ماهی مقدار مورد نیاز فسفولیپید جیره را 1 تا 3 درصد جیره عنوان کرده اند. در ماهیان بزرگ ، بدلیل توانایی سنتز فسفولیپیدها گنجاندن آنها در جیره ضرورت ندارد ولی با این حال سنتز فسفولیپیدها یک عامل محدود کننده در دیگر ماهیان همه چیز خوار محسوب میشود. در نمودار (1) تفاوت افزودن کولین و اینوزیتول بشکل آزاد به جیره کپور ماهی را در مقایسه با کولین و اینوزیتول بشکل فسفوتیدیل کولین و فسفوتیدیل اینوزیتول بر توده زنده (Theoretical biomass) ماهی کپور را نشان میدهد (Coutteau et al. 1997). کمپلکس بودن فسفوتیدها (فسفوتیدیل کولین و فسفوتیدیل اینوزیتول) با کولین و اینوزیتول، موجب اصلاح هضم و جذب آنها در مقایسه با کولین و اینوزیتول خالص در ماهی می شود. این اصلاح در هضم و جذب با محافظت از بافت روده از مواد سمی حاصل از مرحله نهایی پراکسیداسیون چربی های محیط منشا می گیرد(Poston 1991b)).
نمودار1. اثر مکمل سازی کولین و اینوزیتول به شکل آزاد در مقایسه با حالت فسفوریله بر توده زنده ماهی کپور.
اثر متقابل شرایط محیطی بر هضم و جذب چربی ها
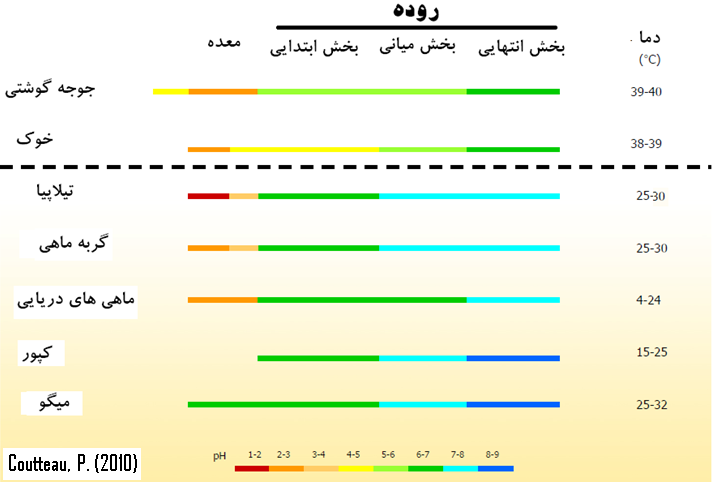
اغلب آبزیان به دلایلی از قبیل شرایط متفاوت دستگاه گوارش و آنزیمی پاسخ متفاوتی به چربی و افزودنی های جیره در مقایسه با تک معده ای های خونگرم از قبیل طیور و خوک دارند. ماهی ها جزء آبزیان خونسرد هستند و دمای بدن آنها بر اساس دمای محیط تغییر میکند. معمولا دمای بدن در آبزیان بدلیل پایین بودن دمای آب پایین تر از میانگین دمای بدن در حیوانات خونگرم است. شکل (1) دما وpH را در گونههای مختلف آبزی و تک معده ای ها مقایسه میکند (Coutteau, 2010). فعالیت و ترشح آنزیم های هضمی بطور موثر تحت تاثیر دما قرار میگیرد، بنابراین ترشح و عملکرد آنزیم های هضمی در ماهیها بر خلاف موجودات خونگرم متغیر و تحت تاثیر دمای محیط تغییر میکند. هضم چربیها با کاهش دما بطور معنی دار کاهش می یابد. این شرایط دمایی بویژه زمان استفاده از چربی های اشباع یا چربی های حیوانی با نقطه ذوب بالا بسیار مشهود خواهد بود. گزارش های متعددی کاهش هضم چربی ها را با کاهش دما در ماهی ها تایید کرده اند. این یافته ها اهمیت نقطه ذوب چربی ها را در هضم چربی نشان میدهد. اهمیت دمای بدن و محیط هضمی در سوخت و ساز چربی بویژه در سنین پایین و در لارو ماهیها بیشتر نمود می یابند (Bendikens et al., 2003; yamamoto et al., 2007).
آرتیفایر به دلیل دارا بودن حداقل 4 نوع لیزو فسفولیپید و ملکول خاص PGER که به عنوان امولسیفایرهای قدرتمند در تشکیل میسل شناخته میشوند میتواند در شرایط دمایی پایین محدودیت های تشکیل میسل را تعدیل و افزایش دهنده هضم چربی ها باشد. از طرفی در صورت افزایش دمای محیط آرتیفایر به دلیل خواص آنتی اکسیدانی با جلوگیری از پراکسیداسیون چربی مانع از آسیب محصولات نهایی حاصل پراکسیداسیون چربی ها در در دستگاه گوارش به بافت پوششی و اپتلیوم دستگاه گوارش خواهد شد.
شکل 1. مقایسه دمای محیط و pH دستگاه گوارش در آبزیان در مقایسه با خوک و جوجه گوشتی
پروتئین های گیاهی و هضم و جذب چربی ها
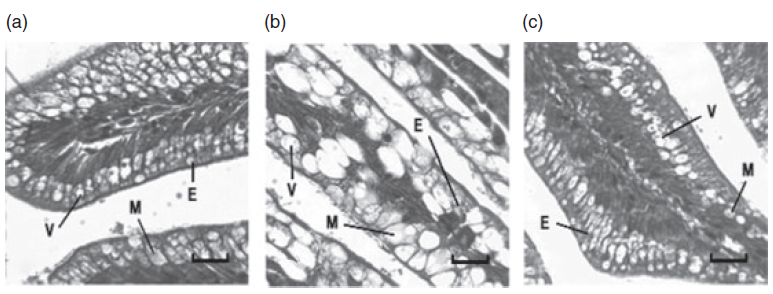
امروزه بدلیل اقتصادی یا برخی محدودیت ها از منابع گیاهی بجای منابع حیوانی یا دریایی برای تامین احتیاجات پروتئین و انرژی آبزیان استفاده میشود. استفاده از این منابع گیاهی در تامین پروتئین و چربی جیره آبزیان میتواند موجب کاهش راندمان جیره به دلیل کاهش قابلیت هضم چربی و پروتئین شود (Krogdahl et al. 2003). کاهش هیدروکسیلاسیون نمک های صفراوی در اثر تغذیه پروتئین های گیاهی و وجود مواد ضد تغذیه ای در این منابع دو علت اصلی کاهش قابلیت هضم چربی ها با تغذیه این منابع پروتئینی می باشد. به عنوان مثال ساپونین موجود در کنجاله سویا میتواند از دسترس خارج شدن و دفع نمک های صفراوی را افزایش دهد. نتایج آزمایشات (Yamamoto et al., 2007) نشان داد که استفاده از کنجاله سویا در جیره ماهی قزل آلا میتواند موجب آسیب به بخش انتهایی روده (شکل 2) و رشد کمتر، کاهش هضم چربی و کربوهیدرات و کاهش برخی پارامترهای خونی از جمله هموگلوبین گردد. افزودن یک امولسیفایر به جیره حاوی کنجاله سویا از اثرات منفی ان کاسته و موجب بهبود قابلیت هضم چربی و کربوهیدرات گردید.
شکل2. اثر استفاده از پروتئین گیاهی بر سطح دستگاه گوارش ماهی قزل آلا .a) ماهی تغذیه شده با پروتئین غیر گیاهی و سطح نرمال روده b) آسیب سطح جذبی روده در ماهی های تغذیه شده با پروتئین سویا c ) سطح روده نرمال در ماهی تغذیه شده با پروتئین سویا به همراه امولسیفایر.
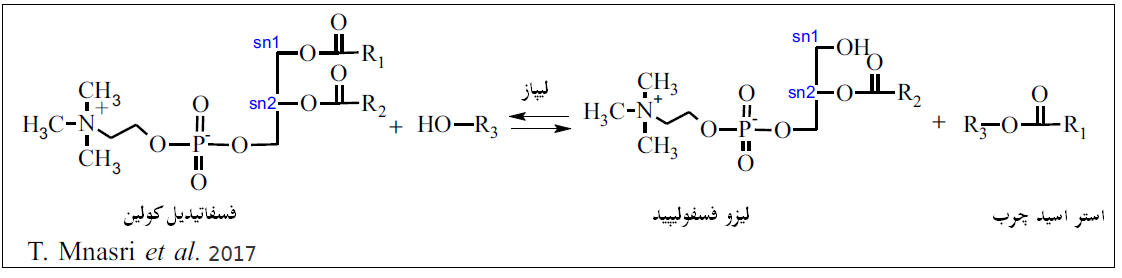
اهمیت لیزو فسفولیپیدها در مقایسه با فسفولیپیدها:
لیزوگلیسروفسفولیپیدها یا لیزو فسفولیپیدها (LPLs) لیپیدهایی بر پایه گلیسرول هستند که گروه فسفات آنها به یک الکل یا آمینو الکل مثل کولین، اتانول آمین، اینوزیتول و سرین، استری شده و لیزوفسفولیپیدهایی مثل لیزوفسفاتیدیل کولین و اتانول امین را تشکیل می دهد (T. Mnasri, et al., 2017). فسفولیپیدهایی از قبیل فسفوتیدیل کولین با منشاء جیره (منابع گیاهی مثل سویا) یا صفرا، برخی مواقع اثرات مورد انتظار بر قابلیت هضم چربی ها را در آبزیان ندارند، در حالی که با برطرف شدن برخی اثرات ممانعت کنندگی و تبدیل آنها به لیزو فسفو لیپیدها، اثر قابل توجهی بر قابلیت هضم چربی ها دارند (Sung & Sang., 2001). شکل 3 نحوه سنتز آنزیمی لیزوفسفولیپیدها از لسیتین هایی گیاهی استخراج شده از سویا و آفتابگردان را نشان میدهد. آنزیم فسفولیپاز A2 مسئول سنتز این فرایند است. بطور کلی و علاوه بر مورد ذکر شده لیزو فسفولیپیدها از جنبه های ذیل در تغذیه تک معده ای ها و آبزیان حائز اهمیت است.
شکل 3. سنتز آنزیمی لیزوفسفولیپیدها از لسیتین ها
اثر تغذیه ی لیزو
لیزوفسفوتیدیل کولین (Lysophosphatidylcholine)
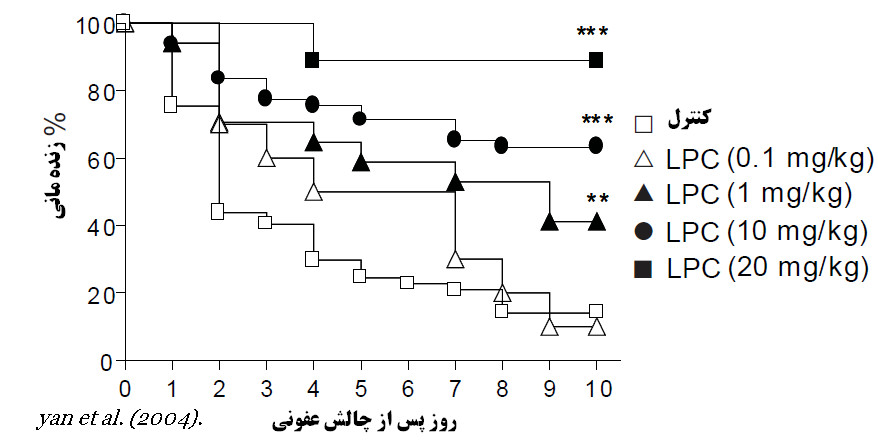
لیزو فسفوتیدیل کولین (LPC) علاوه بر نقش های مشخص در امولسیفه کردن چربیها (که میتواند موجب افزایش هضم چربی بویژه در آبزیان گردد) دارای قابلیت های شگفت انگیزی در افزایش ایمنی در مقابل باکتری های بیماریزا و ممانعت از عفونت های باکتری میباشد. آزمایشات (Yan et al., 2004) نشان داد LPC با افزایش تولید H2O2 در نوتروفیل ها موجب هضم باکتری مهاجم و افزایش قدرت ضد باکتریایی نوتروفیل ها می شود که در نهایت باعث پیشگیری یا مانع از بروز یا توسعه عفونت خواهد شد. این فرضیه از طریق مقایسه تلفات ناشی از القا عفونت باکتریایی E. coli و تغذیه سطوح مختلف LPC اثبات شد. نمودار (2) مقایسه تلفات ناشی از عفونت باکتریایی و اثر تغذیه سطوح مختلف LPC را نشان میدهد که حاکی از تاثیر شگفت انگیز تغذیه LPC در کاهش تلفات ناشی از عفونت می باشد.
نمودار 2. اثرتغذیه سطوح مختلف LPC بر درصد زنده مانی در یک دوره 10 روزه و پس از ایجاد چالش عفونی.
منابع:
Akeshi Yamamoto., Takao Shima., Hirofumi Furuita., Tsuyoshi Sugita, Nobuhiro Suzuki (2007). Effects of feeding time, water temperature, feeding frequency and dietary composition on apparent nutrient digestibility in rainbow trout Oncorhynchus mykiss and common carp Cyprinus carpi 161-170
Coutteau, P. (2010) stabilizing formulation cost and performance of aquafeeds require s innovative approaches. Asia Pacific’s primer aqua feed conference.
Coutteau, P., I. Geurden, M. R. Camara, P. Bergot, and P. Sorgeloos. 1997. Review of the dietary effects of phospholipids in fish and crustacean larviculture. Aquaculture 155:149–164.
Heidi A. H, Jesse T. T.,Brian R. G. and Jérôme, L. (2015) Amending Reduced Fish Meal Feeds with Phospholipids to Improve Performance of Hybrid Striped Bass. Journal of Animal Research and Nutrition, Vol. 1 No. 1:7
Kasinos M, Goñi ML, Nguyen MT, et al. 2014. Effect of hydrolysed sunflower lecithin on the heat-induced coagulation of recombined concentrated milk emulsions. Int Dairy J 38: 187–194
Kasper, C. S. and P. B. Brown. 2003. Growth improved in juvenile Nile tilapia fed phosphatidylcholine. North American Journal of Aquaculture 65:39–43.
Krogdahl, A., Bakke-McKellep, A.M., Baeverfjord, G., 2003. Effects of graded levels of standard soybean meal on intestinal structure, mucosal enzyme activities, and pancreatic response in Atlantic salmon (Salmo salar L.). Aquaculture Nutrition 9, 361–371
Nakano T., Inoue I. and Shinozaki R. et al. (2009) A possible role of lysophospholipids produced by calcium-independent phospholi pase A(2) in membrane-raft budding and fission. Biochim. Biophys. Acta 1788, 2222–2228
Niu, J., Y. J. Liu, L. X. Tian, K. S. Mai, H. J. Yang, C. X. Ye, and Y. Zhu. 2008. Effects of dietary phospholipid level in cobia (Rachycentron canadum) larvae: growth, survival, plasma lipids and enzymes of lipid metabolism. Fish Physiology and Biochemistry 34:9–17.
Poston, H. A. 1991b. Response of Atlantic salmon fry to feed-grade lecithin and choline. Progressive Fish Culturist 53:224–228.
Sugawara, T et al. (2001) Lysophosphatidylcholine enhances carotenoid uptake from mixed micelles by Caco-2 human intestinal cells. J Nutr. ;131(11):2921-7
Sung I. Koo & Sang K. Noh (2001). Phosphatidylcholine Inhibits and Lysophosphatidylcholine Enhances the Lymphatic Absorption of a-Tocopherol in Adult Rats. J .Nutr. 131(3):717-22
T. Mnasri, et al., (2017) Lipase-catalyzed production of lysophospholipids, Oilseeds & fats Crops and Lipids.
Tocher, D. R., E. إ. Bendiksen, P. J. Campbell, and J. G. Bell. 2008. The role of phospholipids in nutrition and metabolism of teleost fish. Aquaculture 280:21–34.
yan et al. (2004). Therapeutic effects of lysophosphatidylcholine in experimental sepsis. Nature Medicine , 10:161-167



.jpg)

.jpg)
.jpg)